
引言:计算机化系统合规建设的必要性与紧迫性
GxP领域的计算机化系统验证(Computerized System Validation,以下简称为CSV)是指通过系统性证据证明计算机化系统(包括硬件、软件、网络等)能够持续满足预定用途和法规要求的过程。其目标是确保系统在整个生命周期中数据的准确性、完整性和可靠性,最终保障医疗产品质量与患者安全。
1、GxP法规要求的演进
2、风险驱动验证的必要性
企业在计算机化系统验证工作中面临法规、技术、成本等多维度挑战。
1.多重法规要求:若企业产品销往国外,需同时遵循国内外监管机构的合规要求,尽管各监管机构在核心原则上保持高度一致(如数据完整性、风险控制等),但在执行细节和监管要求上略有差异,如FDA侧重于实时的合规性监测与保障,EMA则更关注于风险评估的全面性和充分性等。因此企业需针对目标市场制定合规验证策略,以满足多元化的法规要求。同时,企业需实时跟踪法规动态,同步更新合规验证策略。
2.技术复杂:计算机化系统通常涉及多种业务场景、多个功能模块,从系统选型、使用、变更到退役的全生命周期均需兼顾功能与合规性的双重要求。因此,验证复杂系统需要多学科(如法规、业务、IT)知识和技能。既熟悉GxP又精通业务,还懂IT技术的复合型人才少之又少,人才断层带来的培训成本亦难以估量。
3.成本较高:企业往往低估了计算机化系统验证的复杂性,实际执行过程中,需要调动多部门人员配合,且周期较长,耗费大量成本。此外,风险等级不同系统的验证标准和方法也存在差异(如office和MES)。若验证策略不合理,不仅会增加验证成本,还可能带来合规风险。
综上,计算机化系统验证面临的多维度挑战不容小觑。企业需高度重视并积极探寻有效的应对方法,以确保计算机化系统在符合法规要求的同时,实现系统高效稳定运行,为企业的长远发展奠定坚实基础。
基于企业在计算机化系统验证工作中面临的诸多挑战,如何低成本、高效率、合规化地开展验证工作已成为医疗器械行业数智化转型的关键课题。
国际制药工程协会(ISPE)发布的GAMP 5是被全球监管机构广泛认可的最佳实践。GAMP5强调验证应贯穿系统整个生命周期,包括概念提出、需求理解、系统开发、测试验证、部署运行直至系统退役,通过V模型的文件架构形成系统验证流程,确保每个阶段均有明确交付物(如URS、测试报告),形成完整的“证据链”。
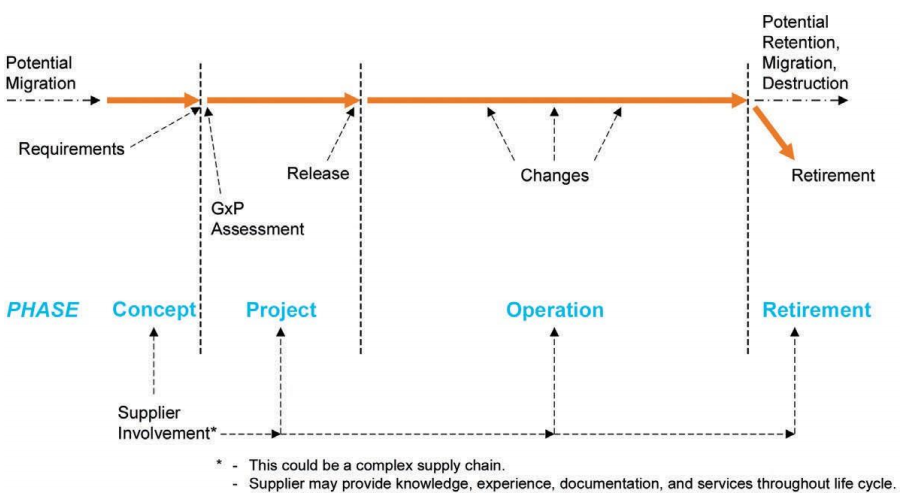
图1 计算机化系统全生命周期阶段定义
GAMP 5的核心逻辑是通过系统分类、风险管理、系统测试和供应商协作,实现验证资源的科学分配,确保计算机化系统稳定、可靠和合规。
1、系统分类:验证策略的基石
根据系统的复杂性、配置化、定制化程度,将计算机化系统进行分类管理,分类结果直接影响验证主计划(VMP)的制定。根据系统分类可明确验证优先级、确定验证深度、指导差异化的验证策略。通过分类,企业可避免“一股脑”式验证,例如对商用标准软件和不可配置类系统简化测试流程,而对定制化系统投入更多资源。
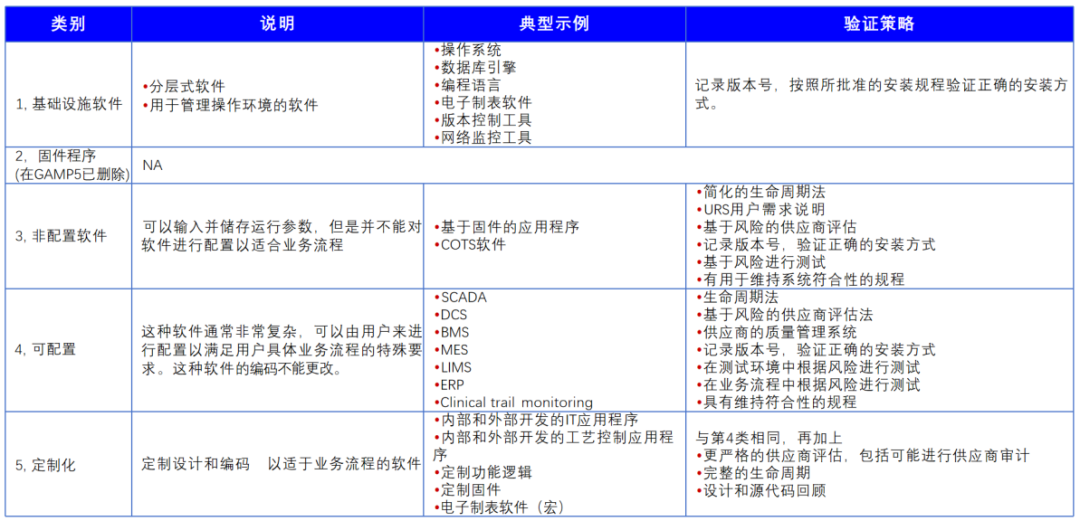
图2 计算机化系统分类、示例与验证策略
2、风险管理:贯穿全过程的验证活动
在医疗器械行业数字化转型的浪潮中,基于风险的GxP计算机化系统验证不仅是满足国内外法规的刚性要求,更是企业构建合规运营体系的坚实基石。通过选择合适的计算机化系统,结合GAMP5标准的V模型验证流程,以风险管理贯穿系统全生命周期,借助供应商提供的外部支持,企业能够低成本、高效率、合规化地完成验证工作。未来,企业需将“主动控险”思维融入数字化转型,持续优化合规体系,培养专业人才,在日益严格的监管环境中筑牢防线,为患者安全和行业创新提供坚实保障。
编:王敏
